Carbonate de calcium
Le carbonate de calcium se compose d'un ion carbonate et d'un ion calcium, sa masse molaire est de 100 g/mole.
Recherche sur Google Images :

Source image : www.jacuzzi.eu Cette image est un résultat de recherche de Google Image. Elle est peut-être réduite par rapport à l'originale et/ou protégée par des droits d'auteur. |
Page(s) en rapport avec ce sujet :
- Il est connu sous le nom de Carbonate de Calcium Précipité (CCP).... dépôt à la surface du papier d'un mélange de charges minérales, de latex et d'eau..... Le carbonate de calcium est la charge la plus utilisée du fait de sa blancheur... (source : eng)
- Le carbonate de calcium est un produit polyvalent utilisé en cosmétique... les passant 10 minutes à l'eau bouillante puis en les séchant soigneusement avec... (source : aroma-zone)
- Le carbonate de calcium est transféré du blanchet à la plaque, on voit alors apparaître des larrons et une teinte de fond ce qui rend l'eau moins réceptive... (source : unigraphinternational)
| Carbonate de calcium | |
|---|---|
 |
|
| Général | |
| Nom IUPAC | Carbonate de calcium |
| N° CAS | |
| N° EINECS | |
| PubChem | |
| SMILES |
|
| InChI |
|
| Apparence | poudre blanche |
| Propriétés chimiques | |
| Formule brute | CaCO3 |
| Masse molaire | 100, 086973 g∙mol-1 C 12%, Ca 40, 04%, O 47, 96%, |
| Propriétés physiques | |
| T° fusion | 825 °C |
| T° ébullition | décomposition |
| Solubilité | Insoluble dans l'eau |
| Masse volumique | 2, 83 solide |
| Thermochimie | |
| S0solide | 93 J/mol·K |
| ΔfH0liquide | -1154 kJ/mol |
| ΔfH0solide | -1207 kJ/mol |
|
|
|
Le carbonate de calcium (CaCO3) se compose d'un ion carbonate (CO32-) et d'un ion calcium (Ca2+), sa masse molaire est de 100 g/mole.
C'est le composant principal du calcaire et de la craie, mais également du marbre. C'est aussi le principal constituant des coquilles d'animaux marins et des escargots.
Le carbonate de calcium cristallise naturellement avec deux formes cristallines principales : l'aragonite et la calcite. Les deux autres formes cristallines sont plus rares : la vatérite & un hexahydrate, forme intermédiaire peu stable qui évolue vers la calcite. Il peut se présenter, dans les processus de cristallisation, sous forme de colloïde contenant de fins cristaux des formes plus stables.
L'ion bicarbonate est à la base de la formation du carbonate de calcium (CaCO3) qui est insoluble dans l'eau et est le constituant principal du calcaire :
(H2CO3 est l'acide carbonique)
Par contre, en milieu acide, le carbonate de calcium se transforme en bicarbonate de calcium (Ca (HCO3) 2 ou Ca2 +, 2 HCO3−), particulièrement soluble dans l'eau.
C'est par conséquent formellement un sel, d'une base faible (Ca (OH) 2 - pKa = 12, 6) et d'un acide faible (H2CO3 - pKa = 6, 35), capable de réagir avec les acides pour donner des sels de calcium, de l'eau et du dioxyde de carbone, qui est à la pression atmosphérique ainsi qu'à température ambiante, gazeux et volatil :
À partir de 800 °C, il se forme une réaction de décomposition fortement endothermique :
CaO est la chaux vive, qui fait l'objet d'une importante industrie. C'est d'ailleurs pour cette réaction que le carbonate de calcium porte, dans certaines industries, le nom de carbonate de chaux, qui était l'ancien nom avant que le calcium ne soit isolé.
Chimie de l'état naturel
Le carbonate de calcium est particulièrement faiblement soluble dans l'eau pure (de l'ordre de 15 à 20 mg/l à 25 °C), mais soluble dans l'eau chargée de gaz carbonique. Or la solubilité des gaz dans l'eau augmente avec la pression et , au contraire de celle de la majorité des solides, diminue quand la température augmente. Ceci explique certains phénomènes naturels.
- A titre d'exemple, le carbonate de calcium se dépose dans les chaudières et sur le fond des bouilloires. Il se dépose aussi à la sortie des robinets, où la pression diminue brusquement.
- Certaines sources, nommées pétrifiantes, aux eaux particulièrement riches en gaz carbonique, contiennent une très grande quantité de carbonate de calcium. En arrivant à l'air libre, elles perdent leur gaz carbonique et déposent en partie le carbonate dissout. Des objets exposés quelques jours à l'action de ces eaux se trouvent incrustés dans une couche de calcite.
- Un phénomène analogue explique les concrétions des grottes. L'eau, chargée de gaz carbonique, dissout le calcaire des roches qu'elle traverse et , en arrivant au contact de l'air, plus chaud, des cavités, elle dépose la calcite transportée. Celle-ci s'accumule en stalactites aux lieux où l'eau se détache du plafond ou en stalagmites aux lieux où les gouttes d'eau tombent sur le sol.
La biochimie de la sécrétion de leur coquille par les mollusques, et de la formation du squelette chez les animaux, n'est pas toujours complètement comprise. Mais il est probable que la teneur des gaz en dissolution joue un rôle essentiel.
Et sur Mars ?
Le carbonate de calcium est sur la planète Terre, un marqueur fort de la présence passée et actuelle de la vie. Sur Mars, voilà plusieurs décennies que des engins automatiques, en orbite ou en surface, tentent d'en détecter la présence. Sans succès jusqu'à la sonde américaine Phœnix Mars Lander, qui selon un communiqué de la NASA datant du 29 septembre 2008, aurait grâce à ses instruments TEGA et MECA, découvert dans le sous-sol, la présence de carbonate de calcium.
Bibliographie
- Le Carbonate de Chaux, J. DEDEK, Librairie Universitaire Louvain, 1966
Liens externes
- Eaux pétrifiantes http ://natura2000. environnement. gouv. fr/habitats/HAB7220. html
- Concrétions http ://www. grandroc. com/geologie. htm
- CARBONATE DE CALCIUM
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 24/03/2009.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.

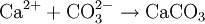
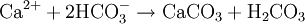
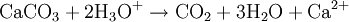
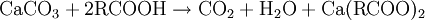
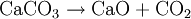

 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité